Strukturbildung in der Biophysik
Forschungsbericht (importiert) 2005 - Max-Planck-Institut für Dynamik und Selbstorganisation
Komplexe nichtlineare, dynamische Systeme fernab vom Gleichgewicht sind allgegenwärtig in der Natur. Nichtlinearität beeinflusst alle Ebenen unseres täglichen Lebens von Ökologie, Soziologie, über Biologie und Medizin, zu Chemie und Physik. So unterschiedlich diese Systeme auch sein mögen, so zeigen viele jedoch eine augenfällige Gemeinsamkeit: die Fähigkeit zur Bildung raumzeitlicher Strukturen.
Dieses Phänomen der Selbstorganisation steht im Zentrum der biophysikalischen Forschung unserer Abteilung: von der Dynamik und Interaktion von Zellen bis zur elektrophysiologischen Komplexität eines Organs. In diesem Beitrag wird beispielhaft die Musterbildung in der Chemotaxis beschrieben, d. h. der Bewegung von Zellen als Folge chemischer Stimuli und die Bedeutung raumzeitlicher Strukturen für das Verständnis von Herzarrhythmien.
Chemotaxis: Zellen auf Wanderschaft
Chemotaxis - die gerichtete Bewegung von Zellen in Antwort auf chemische Stimuli - ist ein Schlüsselphänomen unterschiedlichster biologischer Prozesse. Alltägliche Stoffwechselvorgänge, wie die Wundheilung, werden von den chemotaktischen Eigenschaften der beteiligten Zellen bestimmt, ebenso wie die Metastasis von Krebszellen oder der Ablauf der embryonalen Morphogenese. Chemotaxis ist daher seit Jahrzehnten der Gegenstand intensiver interdisziplinärer Forschungsbemühungen. Einer der prominentesten Modellorganismen zur Untersuchung des chemotaktischen Verhaltens eukaryotischer Zellen ist die einzellige Amöbe Dictyostelium discoideum. Erste Details der molekularen intrazellulären Signalnetzwerke, die für die chemotaktischen Eigenschaften eukaryotischer Zellen entscheidend sind, wurden in den vergangenen zehn Jahren durch umfangreiche molekularbiologische Untersuchungen an D. discoideum entschlüsselt (siehe z. B. [1]). Von einem umfassenden Bild der chemotaktischen Bewegung, das den Zellstoffwechsel auf molekularer Ebene mit der makroskopischen Bewegung der Zellen verbindet, ist der Stand der Forschung jedoch weit entfernt. Für einen ersten Schritt in Richtung eines solchen integrierten Chemotaxis-Modells ist die systematische Erhebung von Daten erforderlich, die die Fortbewegung der Zelle in Abhängigkeit von chemischen Signalen quantitativ erfasst.
Gegenstand der aktuellen Arbeiten in unserer Gruppe ist die Nutzung der Mikrofluidik zur quantitativen Kontrolle der chemischen Umgebung chemotaktisch aktiver Zellen. Mithilfe weicher Lithographie werden mikrofluidische Messzellen hergestellt, deren Längenskalen mit denen einzelner D. discoideum-Zellen vergleichbar sind und eine präzise Manipulation der räumlichen und zeitlichen Verteilung des Signalstoffes cAMP (cyclic adenosine 3’,5’-monophosphate) im unmittelbaren Umfeld der Zellen erlauben. Die Mikrofabrikation findet in Zusammenarbeit mit dem Center for Nano-Biotechnology der Cornell University in Ithaca, New York, statt. Zudem bestehen enge Kooperationen mit den Arbeitsgruppen C. Franck (Cornell University), W. F. Loomis, W.-J. Rappel und H. Levine (University of California at San Diego), sowie G. Gerisch (MPI für Biochemie, Martinsried). Im Rahmen der einzelnen Forschungsvorhaben wird einerseits die Motilität der Zellen in zeitlich konstanten, linearen Gradienten von cAMP systematisch untersucht. Andererseits wird die raumzeitliche Lokalisierung von Stoffwechselprodukten während der chemotaktischen Bewegung im Inneren der Zelle mithilfe von Fluoreszenz-Mikroskopie beobachtet. Ergebnisse des erstgenannten Projektes werden im folgenden exemplarisch vorgestellt (siehe auch [2]).
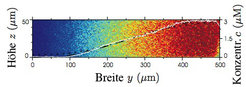
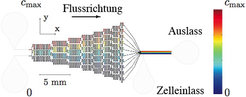
In einem Mikrokanal-Netzwerk wird durch sukzessives Aufteilen und Mischen ein linearer Konzentrationsgradient zwischen einer gewählten Minimal- und Maximalkonzentration aufgebaut (Abb. 1). Im Vergleich zu einem einfachen Mikropipetten-Versuch oder einer herkömmlichen Gradientenkammer besitzt das Mikrokanal-Experiment den Vorteil, dass exakt definierte lineare Gradienten erzeugt und beliebig lange aufrecht erhalten werden können (Abb. 2). Außerdem entfernt ein kontinuierlicher Fluss durch die Messkammer Abbauprodukte und Signalstoffe, die von den Zellen im Laufe des Experiments abgesondert werden.
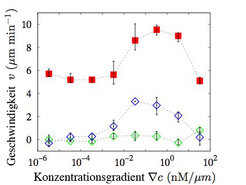
In einer Reihe von Versuchen wird die Steigung im Gradienten des Signalstoffes cAMP systematisch variiert und die chemotaktische Antwort von D. discoideum-Zellen als Funktion des Gradienten vermessen. Abbildung 3 zeigt die Motilität (Betrag der Geschwindigkeit) der Zellen, sowie die Geschwindigkeitskomponenten in Richtung des Konzentrationsgradienten (chemotaktische Geschwindigkeit) und senkrecht zur Richtung des Gradienten. Es wird ein unterer Schwellwert (um 1pM pro µm) im Gradienten für das Auftreten chemotaktischer Bewegung beobachtet. Diese Fähigkeit der Zellen zur Detektion extrem flacher Gradienten zeugt von der hochgradigen Nichtlinearität der für die Chemotaxis bestimmenden intrazellulären Signalverarbeitung. Ferner demonstriert eine chemotaktische Aktivität über drei Größenordnungen im Gradienten die erstaunliche Adaptionsfähigkeit dieser komplexen biochemischen Netzwerke.
Herzdynamik: Dem plötzlichen Herztod auf der Spur
Herzarrhythmien zählen zu den häufigsten Todesursachen in den Industrieländern und fordern allein in Deutschland etwa 100.000 Opfer jährlich. Der plötzliche Herztod ist die Folge einer schnell fortschreitenden elektromechanischen Fehlfunktion des Herzens, deren grundlegende Mechanismen jedoch noch nicht ausreichend bekannt sind. Daher sind Frühdiagnostik und präventive Maßnahmen nur sehr begrenzt möglich.
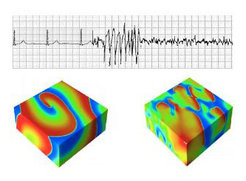
Während der normalen Herzfunktion führen periodische elektrische Anregungswellen zur regelmäßigen Kontraktion des Herzens. Der Übergang von Anregung durch periodische ebene Wellen zu Spiralwellen und raumzeitlichem Chaos kann für den Organismus fatale Folgen haben, da bei diesem Übergang zu Herzkammerflattern und –flimmern die kohärenten Kontraktionen des Herzmuskels ausbleiben – eine lebensbedrohliche Arrhythmie mit zumeist tödlichem Ausgang (Abb. 4).
Die interdisziplinäre, experimentelle und numerische Forschung unserer Gruppe hat das Ziel, zum besseren Verständnis dieser Arrhythmien beizutragen. Schwerpunkt der Arbeitsgruppe ist die Entwicklung und Anwendung innovativer physikalischer Messtechnik und Signalverarbeitung mit dem Ziel, die dreidimensionale raumzeitliche Dynamik von Herzgewebe zu untersuchen. Ein solches Verfahren wäre sowohl für die biomedizinische Grundlagenforschung als auch die klinische Anwendung richtungsweisend. In Zusammenarbeit mit dem Department of Biomedical Sciences und dem Center for Nano-Biotechnology an der Universität Cornell, New York, USA, entwickeln wir optische Methoden und Nano-Sonden zur hochaufgelösten Messung der elektrischen Aktivität in der Herzwand.
Modellbildung und numerische Simulation sind ein weiterer zentraler Bestandteil der Gruppe. Die enge Verzahnung von numerischer Simulation und experimenteller Untersuchung ist für das Verständnis der grundlegenden Mechanismen von Arrhythmien wesentlich. Ein Erfolg dieses methodischen Ansatzes ist die Entdeckung der Rolle von periodenverdoppelnden Bifurkationen der elektrophysiologischen Eigenschaften von Herzgewebe beim Entstehen und Aufbrechen von Spiralwellen. In Abbildung 5 wird gezeigt, wie alternans (die Alternation von langen und kurzen Aktionspotentialdauern) entsteht. Numerische Simulationen und Computermodelle zeigen übereinstimmend, dass schnelle periodische Stimulation von Herzgewebe zu raumzeitlicher Heterogenität der zellulären Eigenschaften führen kann. Diese dynamischen Heterogenitäten stellen einen möglichen Mechanismus dar für die Entstehung von Herzarrhythmien [3,4].
Ob dynamische Heterogenitäten, multiple wavelets oder mother rotor Hypothese: Der wesentliche Mechanismus für die Entstehung von Herzarrhythmien ist derzeit Gegenstand der wissenschaftlichen Diskussion. Die Entscheidung hierüber wird wesentlich mitbestimmt werden von der Möglichkeit, die dreidimensionale raumzeitliche Struktur elektrischer Anregung in Herzgewebe experimentell untersuchen zu können. (Bae, Beta, Bödeker, Bodenschatz, Fox, Frank, Glimour, Luther, Loomis Nadkarni, Rappel, Riccio, Song)

![Design eines Mikrokanal-Netzwerkes zur Erzeugung linearer Konzentrationsgradienten. Die farbkodierte Konzentrationsverteilung ist das Resultat einer zweidimensionalen numerischen Simulation der Navier-Stokes- und Advektions-Diffusionsgleichungen in der gezeigten Geometrie (FEMlab 3.1). Aus [2]. Design eines Mikrokanal-Netzwerkes zur Erzeugung linearer Konzentrationsgradienten. Die farbkodierte Konzentrationsverteilung ist das Resultat einer z](https://www.mpg.de/349572/original-1293749860.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MzQ5NTcyfQ%3D%3D--23f382e79e2f7585f6225bc1f4eb9b2f1ff6f526)
![Lineares Konzentrationsprofil im Hauptkanal der in Abbildung 1 gezeigten Gradientenkammer. Die Farbkodierung zeigt die mittels Zwei-Photonen-Mikroskopie aufgenommene Konzentrationsverteilung von Fluoreszein. Das resultierende Konzentrationsprofil (weiße Kurve) wird durch Mittelung über alle z-Ebenen bestimmt. Die schwarze Linie zeigt das entsprechende Resultat einer dreidimensionalen numerischen Simulation (aus [2]). Lineares Konzentrationsprofil im Hauptkanal der in Abbildung 1 gezeigten Gradientenkammer. Die Farbkodierung zeigt die mittels Zwei-Photonen-Mikroskop](https://www.mpg.de/349628/original-1293750319.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MzQ5NjI4fQ%3D%3D--09aab1bbddc696a903e3278074062138dd425ddb)
![Durchschnittliche Zellgeschwindigkeit senkrecht (grün) und parallel (blau) zum Gradienten, sowie die Zellmotilität (rot) für unterschiedliche Gradienten des Signalstoffes cAMP (aus [2]). Durchschnittliche Zellgeschwindigkeit senkrecht (grün) und parallel (blau) zum Gradienten, sowie die Zellmotilität (rot) für unterschiedliche Gradient](https://www.mpg.de/349684/original-1293749917.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MzQ5Njg0fQ%3D%3D--d5777119d9678ec1bec8de95b2bc6ccdd77d03c5)

![Elektrische Alternans und Übergang zum Leitungsblock als Funktion der Zeit entlang einer eindimensionalen Faser im Ionenmodell [3]. Der Leitungsblock ereignet sich zu Zeiten, die in der Abbildung durch gelbe Punkte markiert sind. Elektrische Alternans und Übergang zum Leitungsblock als Funktion der Zeit entlang einer eindimensionalen Faser im Ionenmodell [3]. Der Leitungsblock](https://www.mpg.de/349796/original-1293749598.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MzQ5Nzk2fQ%3D%3D--f475a22ff4aa1fc17f2b1f71d5bed1735adb99af)